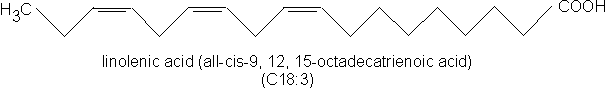
Abbildung: Linolensäure (C18:3)
1. Allgemeines
1.1. Besondere Anforderungen
an analytische Methoden für den Einsatz in der Pflanzenzüchtung
1.2. Bedeutende analytische
Methoden und Schnelltests in der Pflanzenzüchtung
2. Öl- u. Eiweißpflanzen (Beispiele)
2.1. Bestimmung von
Öl- und Proteingehalt
2.2. Selektion auf
bestimmte Fettsäuremuster
2.3. Selektion auf
Proteinqualität
3. NIRS (Nah-Infrarot-Reflexions-Spektroskopie)
3.1. Prinzip der NIR-Spektroskopie
3.2. Probenvorbereitung
3.3. Kalibration
3.4. Besondere Probleme
der NIRS
4. Literatur
Pflanzliche Produkte werden in vielen Fällen sehr spezifisch genutzt, das Vorhandensein von bestimmten Inhaltsstoffen (Proteine (Aminosäuren), Öle (Fettsäuren) Kohlehydrate (Stärke - Amylose oder Amylopektion, Zucker, Cellulose etc.), Mineralstoffe, Vitamine, sekundäre Inhaltsstoffe (z.B. ätherische Öle, Alkaloide, Glykoside etc.), unerwünschte Inhaltsstoffe und Schadstoffe) in bestimmten Konzentrationen ist in der Pflanzenproduktion oft wertbestimmend für das Erntegut (Werteigenschaften für Ernährung oder Fütterung, technologische Verarbeitbarkeit, schädliche Inhaltsstoffe usw.). Daraus ergeben sich Qualitätsanforderungen/Qualitätskriterien an/für Sorten und damit die Notwendigkeit, eine züchterische Selektion auf spezifische Qualitätsmerkmale durchzuführen.
Bespiele von Kulturarten mit sehr spezifischen Qualitätsanforderungen:
Konsequenz:
Der analytische Bedarf der Pflanzenzüchtung ist durch die Vielzahl
der möglichen Parameter in der Qualitätszüchtung und vor
allem durch die notwendigen großen Probenzahlen, die für eine
wirkungsvolle Selektion notwendig sind (Beurteilung von Zuchtstämmen,
evtl. in frühen Generationen, wo wenig Untersuchungsmaterial vorhanden
ist etc.) sehr hoch und vielfältig. In zahlreichen Fällen der
Qualitätszüchtung wurden daher die
- ursprünglichen Untersuchungsmethoden abgewandelt (z.B. Mikro-Kjeldahl),
- Schnellmethoden entwickelt (z.B. Papierchromatographie) oder
- indirekte Methoden (chemische Mehluntersuchungsmethoden od. physikal. Teiguntersuchungsmethoden zur Bestimmung der Backfähigkeit von Getreide, Elektrophorese zum Nachweis bestimmter Proteine, die die Backqualität fördern etc.)
angewandt.
1.1. Besondere Anforderungen an analytische Methoden für den
Einsatz in der Pflanzenzüchtung
a. Analyse großer Probenzahlen in kurzer Zeit, um Selektion betreiben zu können: z.B. bei der Züchtung von Winterraps fällt im Zeitraum zw. Winterrapsernte und Anbau (wenige Wochen) eine große Anzahl an Proben an. Damit verbunden ist ein Bedarf an geschultem Personal, Geräten und Analysenchemikalien für einen kurzen Zeitraum.
b. Kleine Probenmengen: Zur Selektion an Einzelpflanzen in frühen Generationen stehen naturgemäß nur sehr geringe Probenmengen zur Verfügung, da Einzelpflanzenerträge oft klein sind und Teile der Probe für einen eventuellen weiteren Anbau zurückbehalten werden müssen.
c. Zerstörungsfreie Messung (Maximalforderung): Saatgut
soll im Optimalfall nach einer Qualitätsbestimmung/Messung noch keimfähig
bzw. wieder anbaubar sein (v.a. in frühen Züchtungsgenerationen
wichtig).
1.2. Bedeutende analytische Methoden und Schnelltests in der Pflanzenzüchtung
Universelle Methoden:
Stickstoffbestimmung nach Kjeldahl: N-Gehalt, Umrechnung auf Proteingehalt.
Soxhlet-Extraktion: Ölgehalt (Rohfett).
Gaschromatographie (GC): Bestimmung des
Fettsäuremusters u.a. Inhaltsstoffe
NIRS (near-infrared reflectance spectroscopy) bzw.
NIT: Gleichzeitige Bestimmung der Gehalte verschiedenster organischer u.a.
Inhaltsstoffe sowie diverser Qualitätsparameter (siehe weiter unten).
Spezielle Methoden:
Backqualität von Getreide: Bestimmung von Klebermenge (Feuchtklebergehalt),
Kleberqualität (Quellzahl, Sedimentationswert, Schrotgärmethode
usw.), Teiguntersuchungsmethoden (Farinogramm, Extensogramm, Alveogramm),
Amylogramm und Fallzahl bei Roggen.
Bestimmung der Glasigkeit und des Carotinoidgehaltes von Durumweizen.
Mikromälzungen u.ä. zur Bestimmung der Brauqualität
von Gerste.
Polarisation: Zuckergehaltsbestimmung bei Zuckerrüben.
Stärkewaage (Unterwassergewicht): Stärkegehaltsbestimmung
bei Kartoffel.
NMR (nuclear magnetic resonance): Kernresonanzspektroskopie zur Ölgehaltsbestimmung.
Glukosinolatbestimmung bei Raps: GC,
HPLC,
Glukosetest, Sulfattest etc.
Jodzahl-Bestimmung: Test auf den Anteil ungesättigter FS eines
Öls.
Papierchromatographie: Semi-quantitativer Nachweis bestimmter Fettsäuren
oder anderer Komponenten (oft als Halbkornmethode); z.B. Tüpfeltest
auf Gehalt an Erucasäure bei Raps, Thiobarbiturat-Test
zum Nachweis von Linolensäure in Öllein, Raps, Sojabohne,
Leindotter etc.
Jod-Jodkalium-Tests zum Alkaloidnachweis bei Lupinen (Selektion von
Süßlupinengenotypen nach Samen- oder Blatttests).
Bastbestimmung, Bildanalyse etc.: Faserertragsbeurteilung bei Flachs,
Hanf od. Baumwolle.
2. Öl- u. Eiweißpflanzen (Beispiele)
2.1. Bestimmung von Öl- und Proteingehalt
Einsatz universeller Methoden (siehe oben) oder von NIRS (siehe Pkt.
3).
2.2. Selektion auf bestimmte Fettsäuremuster
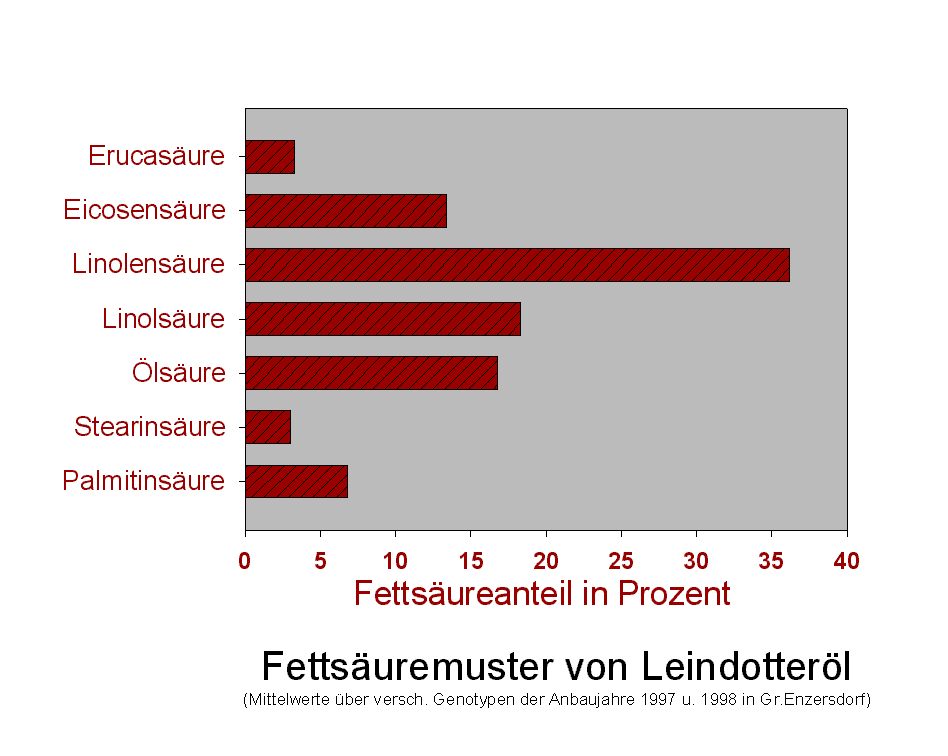
Ölpflanzen zeichnen sich durch charakteristische Fettsäuremuster
aus, die die Verwendungsmöglichkeiten eines Pflanzenöls (Food
/ Non-Food) bestimmen. Rapsöl von 00-Sorten enthält hohe Gehalte
an Ölsäure (C18:1), während Sonnenblumenöl oder Safloröl
Linolsäure (C18:2) als Hauptfettsäure enthalten. Crambeöl
oder Rapsöl von alten Rapssorten enthalten Erucasäure (C22:1),
Leinöl oder Leindotteröl Linolensäure (C18:3) als Hauptfettsäure.
Andere Arten enthalten Fettsäuren mit zusätzlichen funktionellen
Gruppen (z.B. Hydroxyfettsäuren in Lesquerella oder Rizinus) oder
kurzkettige Fettsäuren, z.B. Kokosnuß, Ölpalmen und bestimmte
transgene Rapssorten (Laurinsäure, C12:0).
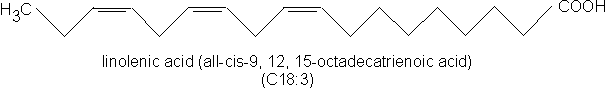
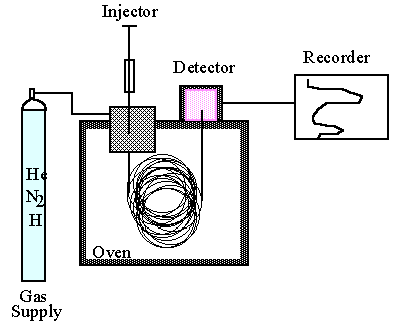
Prinzip der Fettsäureanalytik mittels GC (Gaschromatographie) oder HPLC (High performance liquid chromatography): Aus Pflanzensamen extrahierte Öle werden aus der natürlichen Triglyceridbindung in Methylester umgeestert, danach erfolgt die chromatographische Auftrennung und quantitative Detektion der einzelnen Fettsäuren. Ergebnis: Fettsäuremuster eines Öles (einzelne Fettsäuren in %).
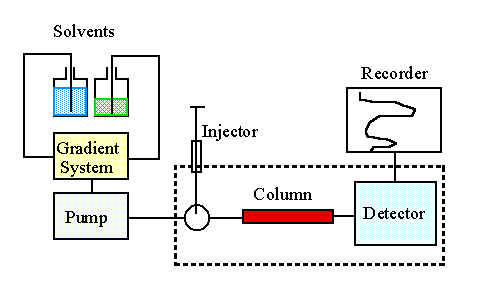
Da die Bestimmung des Fettsäuremusters mittels GC oder HPLC zeit-
und kostenaufwendig ist, wurden Schnellmethoden zum Nachweis einzelner
Fettsäuren entwickelt (z.B. Papierchromatographie für Erucasäure
bei Raps, Thiobarbiturattest für Linolensäure bei Öllein
u.a. Arten), womit große Populationen z.B. nach Mutationsinduktion
zur Selektion auf diese Fettsäuren "gescreent" werden können.
Sowohl GC/HPLC als auch Schnellmethoden sind nach Modifikation auch
an einzelnen Keimblättern ("Halbkornmethode") durchführbar,
so daß aus untersuchten Körnern bei Bedarf noch Pflanzen herangezogen
werden können.
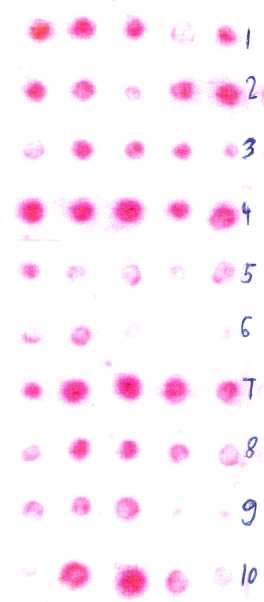
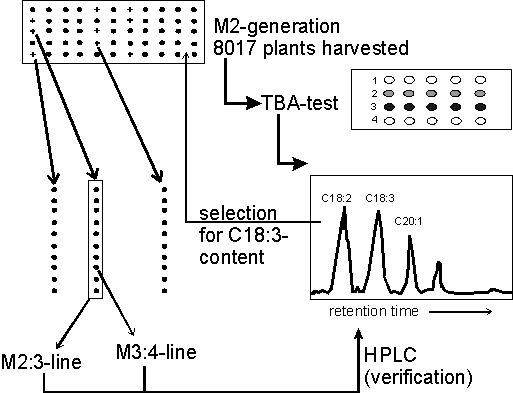
2.3. Selektion auf Proteinqualität
Eine Selektion auf einzelne Aminosäuren mittels HPLC ist sehr kostspielig und wird auch deshalb selten durchgeführt, weil die genetische Variabilität in Aminosäuremustern meist sehr gering ist.
Selektion auf bestimmte Speicherproteine: Mittels Gelelektrophorese (SDS-PAGE) und spezifischer Färbung (z.B. Comassie-Blau) können einzelne Proteine, die sich im Molekulargewicht unterscheiden, sichtbar gemacht werden, z.B. der Kunitz-Trypsininhibitor der Sojabohne.
Damit kann auf Anwesenheit bzw. Abwesenheit eines bestimmten Proteins selektiert werden.
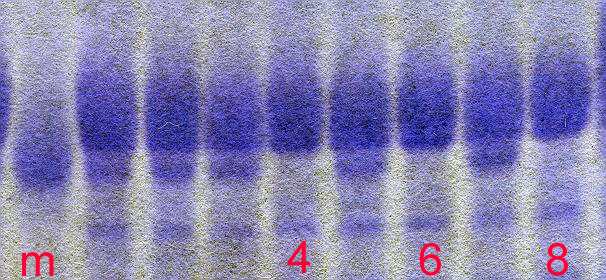
Abbildung: Proteinelektrophorese
(SDS-PAGE) von Sojabohnen (Ausschnitt; den Proben 4, 6 und 8 fehlt die
Proteinfraktion Kunitz-TI in der Position des Markers m)
Selektion auf unerwünschte Begleitstoffe im Schrot: Beispiel
Glucosinolate bei Raps: Glukose-Schnelltest, Sulfattest etc.
3. NIRS (Nah-Infrarot-Reflexions-Spektroskopie)
3.1. Prinzip der NIR-Spektroskopie
NIRS (Near Infrared Reflectance Spectroscopy) und NIT (Near Infrared Transmission Spectroscopy) sind physikalische Analysenmethoden für die quantitative und qualitative Bestimmung von Inhaltsstoffen wie Öl, Protein, Stärke, Rohfaser, Feuchtigkeit, Zucker, freien Fettsäuren, Glucosinolaten u.a. in biologischen Materialien (Samen, Mehle, Lebens- und Futtermittel etc.). Als analytische Schnellmethoden nutzen diese Verfahren die Tatsache, daß Licht im Wellenlängenbereich von etwa 800 bis 2600 nm (naher Infrarotbereich) von organischen Verbindungen absorbiert und reflektiert wird. Diese Absorption ist hauptsächlich auf Bindungen mit CH-, NH-, SH- oder OH- (sowie andere funktionelle Gruppen) zurückzuführen, wodurch sich für einen jeden zu messenden Inhaltsstoff eines Untersuchungsgegenstandes ein typisches Spektrum an Absorptionsbanden (bzw. Kombinationsschwingungen und verschiedene Oberschwingungen) ergibt, das durch einen Detektor unter Verwendung bestimmter Wellenlängen (durch Filter oder Monochromator erreicht) erfaßt wird; aus den so ermittelten Meßdaten werden mittels multipler linearer Regressionsgleichungen und mit Hilfe produktspezifischer Kalibrationsdaten Gehaltswerte für bestimmte Inhaltsstoffe errechnet. Die Dauer einer Messung („Scan“) beträgt meist weniger als eine Minute, wobei verschiedene Inhaltsstoffe einer Probe gleichzeitig erfaßt werden können. Dadurch ist es möglich, mehrere 100 Proben pro Tag zu analysieren, was den Hauptvorteil dieser Untersuchungsmethoden gegenüber naßchemischen Verfahren ausmacht und die Beurteilung einer für züchterische Selektionszwecke ausreichend großen Zahl an Genotypen ohne einen Bedarf an Chemikalien und ohne zeitaufwendige Analysenschritte erlaubt.
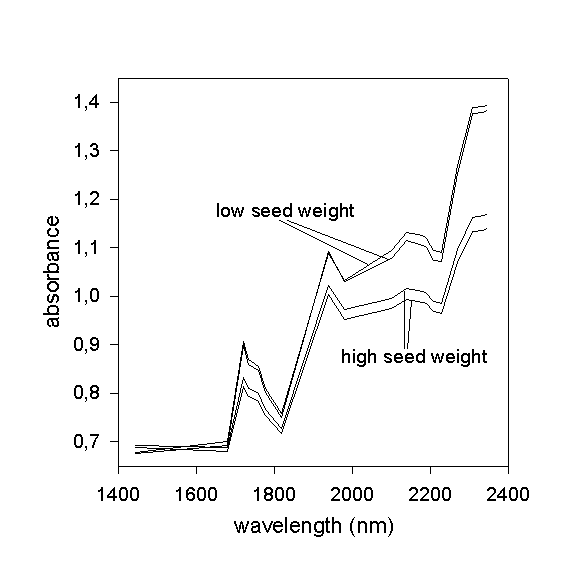
Großkörnige Untersuchungsproben (Ackerbohnen, Sojabohnen,
Getreide etc.) müssen vor der Messung zumeist gleichmäßig
fein vermahlen werden (NIRS), da unterschiedliche Oberflächen, Textureigenschaften,
Korngrößen oder Kornhärten das Meßergebnis beeinflussen
können. Bei einer Messung mit NIT ist eine Vermahlung nicht erforderlich
(Ganzkornmessung). Kleinkörnige Saat-Proben (Raps, Mohn, Leindotter,
Amaranth etc.) können in jedem Fall ohne Zerkleinerung gemessen werden.
Für die Proteingehaltsbestimmung z.B. von Sojabohnen muß zunächst eine Kalibration des Gerätes mit Proben durchgeführt werden, die das gesamte Spektrum an zu erwartenden Untersuchungsproben (Proteingehalte, Korngrößen usw.) repräsentieren sollen. Die Referenzmethode ist dabei eine Protein- bzw. Stickstoffbestimmung nach Kjeldahl; die Eichverfahren für die Bestimmung des Ölgehaltes sind Soxhlet-Extraktion oder die NMR-Methode, für Feuchtigkeitsmessung eine einfache Wassergehaltsbestimmung durch Trocknung und Wägung (gravimetrische Bestimmung). Die eigentliche Kalibration des Gerätes geschieht mathematisch z.B. mittels multipler linearer Regression (MLR) oder „partial least square regression“ (PLSR): Dabei werden Absorptionen bei einzelnen Wellenlängen mit Inhaltsstoffgehalten (aus den Referenzproben) in Verbindung gebracht und sog. Kalibrationsgleichungen erstellt, mit deren Hilfe dann aus den Absorptionswerten unbekannter Proben die Gehalte der einzelnen Inhaltsstoffe (für welche Kalibrationen erstellt wurden) errechnet werden können.
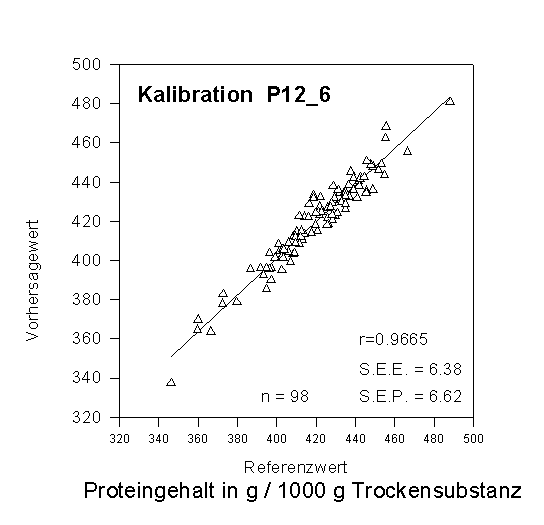
Abbildung: Beispiel für eine NIRS-Kalibration
zur Proteingehaltsbestimmung bei Sojabohnen
3.4. Besondere Probleme der NIRS
Die Reproduzierbarkeit der gemessenen Gehaltswerte über unterschiedliche
Standorte und Anbaujahre bedarf einer ständigen Überprüfung
(Validierung) mit Kontrollproben und erfordert u.U. eine Erweiterung der
NIRS-Kalibration, da verschiedene Umwelten unterschiedliche Reflexionseigenschaften
der Meßproben nach sich ziehen, wodurch Vorhersageergebnisse verfälscht
werden können („bias“).
Bei der Probenahme ist der Stichprobenfehler besonders zu beachten,
da kleine Probenmengen verwendet werden, die durch Entmischungsvorgänge
nicht repräsentativ für die Gesamtheit sein können. Um eine
optimale Probenahme sicherzustellen, können auch mehrere Teilproben
analysiert werden.
FISCHBECK, G., W. PLARRE & W. SCHUSTER, 1985, Lehrbuch
der Züchtung landwirtschaftlicher Kulturpflanzen, Band 2: Spezieller
Teil, P. Parey, Berlin.
LÖSCHENBERGER, F., 1993, Einsatz der NIT-Technik
in der Qualitätszüchtung am Beispiel des Weizens, Bericht über
die Arbeitstagung der Arbeitsgemeinschaft der Saatzuchtleiter, Gumpenstein,
135-143.
MARK, H., 1991, Principles and practice of spectroscopic
calibration, Series Chemical Analysis, Vol. 118, J. Wiley & Sons, New
York.
PAUL, C., 1993, Zerstörungsfreie analytische Techniken
zur Qualitätserfassung in der Pflanzenzüchtung, Bericht über
die Arbeitstagung der Arbeitsgemeinschaft der Saatzuchtleiter, Gumpenstein,
127-134.
REINHART, T.-C. & P. TILLMANN, 1993, Qualitätsbestimmung
von Körnerraps mit Hilfe der Nahinfrarotspektroskopie (NIRS), Bericht
über die Arbeitstagung der Arbeitsgemeinschaft der Saatzuchtleiter,
Gumpenstein, 209.
Siehe auch: "Züchtung auf Qualitätseigenschaften
bei Getreide"