Tabelle 1: Beispiele zur Berechnung der Genotyp- und Allelfrequenzen, bei gleichbleibender Allelfrequenz, jedoch veränderter Genotypfrequenz.
1. Populationsgenetik
1.1. Genotyp- und Allelfrequenzen
1.2. Zufallspaarung und Hardy-Weinberg
Gleichgewicht
2. Quantitative Genetik
2.1. Merkmale und Variation
2.1.1. Polygene, oligogene Vererbung
2.1.2. Umwelteinflüsse
2.1.3. Genotyp-Umwelt Interaktion
2.2. Heritabilität
2.2.1. Zerlegung des genotypischen
Wertes
2.2.2. Arten der Heritabilität
2.2.3. Experimentelle Bestimmungsmethoden
der Heritabilität
2.2.4. Heritabilität einzelner
Merkmale
2.3. Selektionserfolg
2.3.1. Der beobachtete Selektionserfolg
2.3.2. Der erwartete Selektionserfolg
2.3.3. Selektionsintensität
3. Weiterführende Literatur
... beschäftigt sich mit den Prozessen, die die genetische Zusammensetzung von Populationen beeinflussen. Unter "Population" wird eine Gruppe von Pflanzen, die eine Fortpflanzungsgemeinschaft bilden, verstanden. Die Pflanzen einer Population verbindet ein gemeinsamer Genbestand ("Genpool"), der bei der Reproduktion an die Nachkommen weitergegeben wird. Eine Population hat eine zeitliche Kontinuität; sie besteht aus aufeinanderfolgenden Generationen.
1.1. Genotyp- und Allelfrequenzen
Eine Population kann entweder durch die relativen Häufigkeiten
der Genotypen (P, H, Q) oder durch die relativen Häufigkeiten der
Allele (p, q) beschrieben werden. Allelfrequenzen ändern sich vor
allem durch Mutation oder Selektion, dadurch kommt es auch zwangsläufig
zu einer Änderung der Genotypfrequenzen (eine Änderung der Genotypfrequenzen
ist auch möglich, ohne daß sich die Allelfrequenzen ändern!
(siehe Tab. 1)).
Tabelle 1: Beispiele zur Berechnung der Genotyp- und Allelfrequenzen, bei gleichbleibender Allelfrequenz, jedoch veränderter Genotypfrequenz.
1.2. Zufallspaarung und Hardy-Weinberg Gleichgewicht
* P a n m i x i e (‘random mating’) : jede Paarung zwischen zwei Pflanzen einer Population ist gleich wahrscheinlich, z.B. Roggenfeld.
* H a r d y - W e i n b e r g G l e i c h g e w i c h
t :
(1) Genotypfrequenzen ergeben sich aus Allelfrequenzen. Die Genotypfrequenzen
einer zufallspaarenden Population sind konstant, solange sich die Allelfrequenzen
nicht ändern.
(2) Konstante Zusammensetzung einer Population wird bereits durch eine
einzige Generation Zufallspaarung erreicht.
(3) Im Hardy-Weinberg Gleichgewicht haben die Genotypen AA, Aa und
aa die Frequenzen p², 2pq und q².
Seltene Allele (z.B. Lethalgene) kommen unter diesem Gleichgewicht fast nur in heterozygoten Genotypen vor (Homozygote äußerst selten, da Effekte bei Inzucht sichtbar werden!).
Voraussetzungen für Gültigkeit des Hardy-Weinberg Gleichgewichtes:
(1) große Population,
(2) Panmixie,
(3) keine künstliche oder natürliche Selektion,
(4) keine Mutation,
(5) keine Introduktion von Genen von außerhalb der Population.
* Qualitative Merkmale Þ diskontinuierliche
Variation
* Quantitative Merkmale Þ kontinuierliche
Variation
Tabelle 2: Vererbung und Variation verschiedener züchterisch interessanter Merkmale
Der erstmalige Nachweis einer polygenen Vererbung gelang dem Schweden Hermann NILSSON-EHLE, der in einer Weizenkreuzung zwischen einer rot- und weißkörnigen Sorte eine Aufspaltung in der F2 in fünf Farbabstufungen feststellen konnte.
P1 (rot) x P2 (weiß) Þ F1 (rosa) Þ F2 (fünf Farbabstufungen) 1:4:6:4:1
Diese Aufspaltung konnte durch zwei Gene mit je zwei Allelen erklärt werden Þ die F2 folgt einer dihybriden Spaltung. Bei Merkmalen mit mehreren beteiligten Genen wird die Anzahl der Klassen so groß, daß sie nicht mehr unterscheidbar sind und der Eindruck einer kontinuierlichen Variation entsteht.
Das an einer einzelnen Pflanze oder Nachkommenschaft gemessene Merkmal bezeichnet man als den phänotypischen Wert. Er setzt sich aus dem genotypischen Wert und dem Umwelteffekt zusammen. Der genotypische Wert ist der Mittelwert der Pflanzen eines Genotyps über alle denkbaren Umweltbedingungen. Der Umwelteffekt kann positiv oder negativ sein und führt dazu, daß der phänotypische Wert über oder unter dem genotypischen Wert liegt.
Þ 1903: Wilhelm JOHANNSEN (erstmalige Erwähnung der Begriffe ‘Gen’, ‘Genotyp’, ‘Phänotyp’): Experimente über die Vererbung des Samengewichtes bei Phaseolus-Bohne Þ kontinuierliche Variation ist teils genetisch, teils umweltbedingt. Bohnen sind Selbstbefruchter, die Pflanzen einer Sorte sind also homozygot Þ die von einer homozygoten Einzelpflanze abstammenden Nachkommen sind untereinander genetisch identisch und ihre Variation ist rein umweltbedingt Þ ‘Reine Linie’ (‘pure line’) Þ Handelssorte ‘Princess’ war offenbar Gemisch von verschiedenen Genotypen mit genetischen Unterschieden in der Samengröße Þ erste Selektion war daher erfolgreich (Abb. 1).
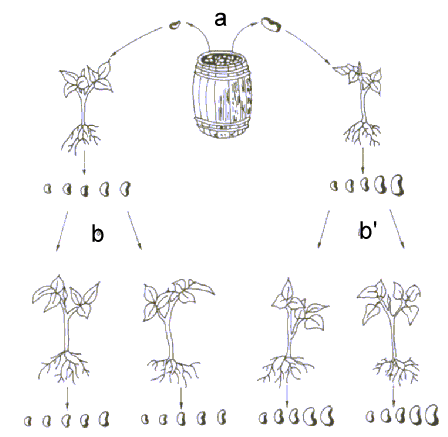
Abb. 1: Johannsen-Experiment (1903): Im ersten Selektionsschritt a wurde die kleinste und die größte Bohne ausgelesen und angesät und das Gewicht der Bohnen der daraus entstehenden Pflanze bestimmt. Im Falle b wurde ein Mittelwert von 0,351 g, für b' 0,643 g festgestellt. Die erste Selektion war also erfolgreich, d.h. die Variation zwischen b und b' kann nur auf den Genotyp zurückgeführt werden. Im zweiten Selektionsschritt (innerhalb der ersten Nachkommenschaften wurden abermals die kleinsten und größten Bohnen ausgelesen und angesät) konnte keine Variation zwischen den einzelnen Teilpopulationen festgestellt werden (b: 0,358 und 0,348 g; b': 0,631 und 0,649 g), d.h. die Variation innerhalb von b und b' bzw. ihrer beiden Teilpopulationen war rein umweltbedingt.
2.1.3. Genotyp-Umwelt Interaktion
* Fixierte Faktoren: Umweltfaktoren, die bereits vor dem Anbau festgelegt werden und bekannt sind, z.B. die klimatische Region und pflanzenbauliche Maßnahmen (Saatzeit, Saatstärke, Düngungsniveau, etc.).
* Zufällige Faktoren: Umweltfaktoren, die eine zufallsbedingte Variation aufweisen und die nicht vorhersagbar sind, z.B. die Jahreswitterung.
Þ (1) Aus einem einzigen Versuch sind kaum allgemeine Schlußfolgerungen möglich, und Ertragsprüfungen müssen immer an mehreren Orten und in mehreren Jahren durchgeführt werden, (2) verschiedene Orte können unterschiedlich gut als Standorte für eine Ertragsprüfung geeignet sein, (3) verschiedene Genotypen können unterschiedlich große Interaktionen aufweisen und es können Genotypen selektiert werden, bei denen diese Interaktionen möglichst gering sind.
Þ Oft ist es von Interesse, eine allgemeine Aussage darüber zu machen, wie wichtig Inter-aktionen im Verhältnis zu den Haupteffekten sind. Eine solche Aussage ist möglich, wenn wir die Varianzen betrachten, also danach fragen, inwieweit die auf-tretende Variation auf Unterschieden in den Genotypen, Umweltbedingungen und/oder Interaktionen beruht.
Erwünscht ist ein Genotyp, der möglichst geringe Interaktionen mit der Umwelt aufweist. (Þ Leistungsstabilität, Ertragssicherheit).
Die Heritabilität („Erblichkeit“) erfaßt die relative Bedeutung des Genotyps für die auftretende Variabilität. Experimentelle Bestimmung, z.B. durch Schätzung von Varianzkomponenten: auf diese Weise kann die Größe der genotypischen Varianz bestimmt und zur Größe der phänotypischen Varianz in Beziehung gesetzt werden; Selektionsexperimente: je höher die Heritabilität, desto größer der Erfolg einer Selektion. Aus einem beobachteten Selektionserfolg läßt sich daher auf die Heritabilität in der Ausgangspopulation rückschließen.
2.2.1. Zerlegung des genotypischen Wertes
Þ Epistasie
Nicht immer kann der genotypische Wert eines Individuums einfach als
Summe der genotypischen Werte einzelner Gene aufgefaßt werden. Es
kommt nämlich vor, daß zwei Gene erst in ihrer Kombination eine
besonders günstige oder ungünstige Wirkung zeigen. Eine solche
Wechselwirkung zwischen verschiedenen Genen wird als Epistasie
(I) bezeichnet.
2.2.2. Arten der Heritabilität
Þ Heritabilität im weiteren Sinne (‘broad sense heritability‘; h²b, H, H²)
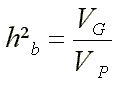
Þ Heritabilität im engeren Sinne (‘narrow sense heritability‘; h²n, h²)
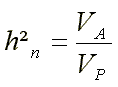
2.2.3. Experimentelle Bestimmungsmethoden der Heritabilität
2.2.3.1 Heritabilität in Kreuzungspopulationen
Idee: Schätzung der Umweltvarianz an genetisch homogenen Populationen (Eltern, F1), Schätzung der Gesamtvarianz (VP) an der F2-Population, die die gesamte genetische Varianz enthält, aber gleichzeitig auch Umweltschwankungen unterliegt.
a) Methode nach Mahmud & Kramer
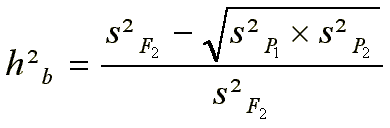
b) Methode nach Weber
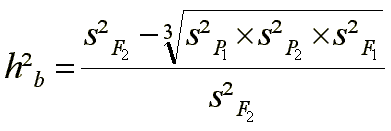
Die Methoden von Mahmud & Kramer und Weber schätzen eine Heritabilität im weiteren Sinne Þ VG wird nicht zerlegt.
c) Methode nach Allard (Rückkreuzungsmethode): Varianzen von Eltern, F1, F2 und der Rückkreuzungen der F1 mit beiden Eltern (B1 und B2) erlauben die Auftrennung der genetischen Varianz VG in die Komponenten VA und VD und damit die Schätzung der Heritabilität im weiteren und im engeren Sinne. VF2, VB1, VB2 sowie VP1, VP2 und VF1 werden aus dem Versuch ermittelt; die Heritabilität wird nach dem Errechnen von VA und VD durch Einsetzen der bekannten Werte in die Gleichungen der Erwartungswerte und anschließender Auflösung der Gleichungen ermittelt.
Erwartungswerte: (1) ![]()
(2) ![]()
Schätzwerte: ![]()
Heritabilität: ![]()
2.2.3.2 Heritabilität durch Eltern-Nachkommen - Regression
![]()
(b ..... Regression der Nachkommen auf die Eltern)
2.2.3.3 Varianzkomponentenmethode („operative Heritabilität“)
Beispiel: Feldversuch, 3 Klone, 3 Orte, Varianzanalyse für das Merkmal Trockenmasseertrag.

Die Berechnung der Heritabilität aufgrund einer Feldversuchsserie
über mehrere Jahre und Orte würde entsprechend der Formel
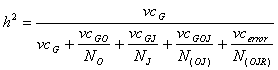
erfolgen, wobei G = Genotypen, O = Orte, J = Jahre und R = Wiederholungen.
2.2.3.4 Realisierte Heritabilität
Abb. 2: Die Schätzung der Heritabilität aufgrund des Selektionserfolges R: Neben dem Selektionserfolg R werden für diese Art der Heritabilitätsschätzung die phänotypische Standardabweichung des selektierten Merkmals in der Ausgangspopulation sP sowie die Selektionsintensität i (standardisiertes Maß für den Prozentanteil an Pflanzen, die aus der Ausgangspopulation selektiert werden) benötigt. (zum vollständigen Verständnis, sowie zur Berechnung von R siehe 2.3)
2.2.4. Heritabilität einzelner Merkmale
Eine mögliche Selektionsreihenfolge nach der Heritabilität
einzelner Merkmale bei der Züchtung selbstbefruchtender Getreidearten:
| Heritabilität | Merkmal | Selektionsbeginn |
| hoch | Best. Resistenzeigenschaften, Reifezeit, Begrannung, Kornfarbe, Spelzenform | F2 - F3 |
| mittel | Korn- u. Ährenmerkmale, Standfestigkeit, Qualitätsmerkmale, ggf. Halmlänge | F4 - F5 |
| niedrig | Ertragskomponenten, Ertragspotential, versch. physiol. Eigenschaften | F7 - F8 |
Ziel einer Selektion auf quantitative Eigenschaften ist es, überlegene Genotypen auszulesen Þ Mittelwert einer Population von Genotypen in einer gewünschten Richtung verschieben. Die Änderung des Mittelwertes einer Population aufgrund von Selektion bezeichnet man als Selektionserfolg, (‘response to selection’, R)
2.3.1. Der beobachtete Selektionserfolg
Þ Die phänotypische Differenz zwischen dem Mittelwert der selektierten Fraktion und dem Mittel der gesamten Population wird als Selektionsdifferential S bezeichnet. Der Selektionserfolg lautet:
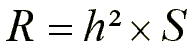
Das Verhältnis zwischen R und S wird als realisierte Heritabilität bezeichnet (siehe 2.2.3.4; Abb.2).
2.3.2. Der erwartete Selektionserfolg
Theoretische Vorhersage des Selektionsgewinns aufgrund der Eigenschaften
einer Population. Der Selektionserfolg ist von drei Faktoren abhängig:
(a) wieviel genetische Variation vorhanden ist,
(b) wie zuverlässig diese Variation zu erkennen ist und
(c) wie stark wird selektiert.
Die Selektionsintensität ist ein standardisierter Koeffizient, der angibt, um wieviele Standardabweichungen das Mittel der selektierten Pflanzen über dem Populationsmittel liegt.
Þ Bei allen Arten sind die Genotyp-Umwelt-Interaktionen
in ihrer Summe größer als die genotypische Varianz. Bei einer
Prüfung an nur einem Standort ist die Varianz zwischen den Prüfgliedern
gleich der Summe aus genotypischer Varianz und Interaktionsvarianz, also
wird bei einer Prüfung an nur einem Standort die genotypische Varianz
sehr stark überschätzt.
Þ Für den Selektionserfolg entscheidend
ist die Heritabilität der Werte, an denen selektiert wird, also die
Heritabilität der Mittelwerte über die Umweltbedingungen und
Wiederholungen, in denen die Prüfung durchgeführt wurde. Eine
Möglichkeit, die Heritabilität bei gleichbleibenden Prüfumfang
zu erhöhen ist die Änderung der Allokation der Prüfparzellen,
d.h. eine bessere Aufteilung der verfügbaren Anzahl an Parzellen auf
Wiederholungen, Jahre und Orte.
Þ Die Heritabilität ist keine
biologische Konstante, sondern sehr stark von der Art der züchterischen
Prüfung abhängig. Bei Prüfungen an nur einem Standort bleibt
auch bei sehr vielen Wiederholungen die Heritabilität niedrig, da
die Interaktionen nicht erfaßt werden. Auf-grund der Genotyp-Jahr-Interaktion
ist die maximal erreichbare Heritabilität bei einjährigen Prüfungen
begrenzt und kann auch durch eine sehr große Anzahl von Orten nicht
auf die Höhe der Heritabilitäten von mehrjährigen Prüfungen
angehoben werden.
Selektionserfolg bei indirekter Selektion mit einem Hilfsmerkmal
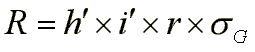
Þ Da der Korrelationskoeffizient r im günstigsten Fall eins werden kann, normalerweise jedoch unter eins liegt, sollten i’ und/oder h’ für das Hilfsmerkmal größer sein als i und h für das Zielmerkmal. Hilfsmerkmale sind also interessant, (a) wenn sie schnell und einfach in einer großen Anzahl an Material zu bestimmen sind, da dies eine höhere Selektionsintensität er-möglicht, (b) wenn sie eine hohe Heritabilität haben, und (c) wenn sie außerdem noch ausreichend hoch mit dem Zuchtziel korreliert sind.
Allard RW, 1960: Principles of Plant Breeding. John Wiley
& Sons, Inc., New York.
Becker H, 1993: Pflanzenzüchtung. Verlag Eugen Ulmer,
Stuttgart.
Böhm H, Schuster W, 1985: Untersuchungen zur Heritabilität
bei Mais (Zea mays L.). Zeitschrift für Pflanzenzüchtung
95: 125-134.
Bos I, Caligari P, 1995: Selection methods in plant breeding.
Chapman & Hall, London.
Gallais A, 1990: Théorie de la sélection
en amélioration des plantes. Masson, Paris.
Mahmud I, Kramer HH, 1951: Segregation for yield, height
and maturity following a soybean cross. Agronomy Journal 43: 605-609.
Siehe auch: Selektion