Einleitung
Arten der Genotyp-Umwelt-Interaktion
Stabilitätskonzepte
Spezieller Teil
(a) Umweltvarianz und Variationskoeffizient
(b) Ökovalenz und Stabilitätsvarianz
(c) Regressionsmethode
(d) Nichtparametrische Methoden
(e) Multivariate Methoden
(f) Methoden unter Berücksichtigung
des Leistungsniveaus
Literatur
termini technici (± synonym
verwendet):
Stabilität, Ertragsstabilität (‘yield stability’), Ertragssicherheit,
Ertragstreue, Adaptation (‘adaptation’), Leistungsstabilität, Ökostabilität,
Umweltstabilität, ökologische Streubreite, phänotypische
Stabilität
‘The word adaptation has a great adaptability’ (Dorst, 1957)Anforderung an eine neue Sorte:‘The concept of stability is defined in many ways depending on how the scientist wishes to look at the problem’ (Lin et al., 1986)
Eine Sorte soll auf allen Standorten eines Anbaugebietes und in allen
Anbaujahren möglichst gleichmäßige (= stabile) Leistungen
erbringen, die sog. Genotyp-Umwelt-Interaktion (GEI) soll möglichst
gering sein.
Daher: Feststellung der Leistungsstabilität durch mehrortige,
mehrjährige Prüfung der Leistungen von Zuchtstämmen, bevor
solche als neue Sorten eingetragen und damit zum praktischen Anbau zugelassen
werden.
„ Der Anbauwert jeder Sorte Getreide, Rüben oder Kartoffeln wird in erster Linie durch den Ertrag bestimmt. Dieser ist jedoch nicht allein für den Anbauwert bestimmend. Neben der absoluten Ertragshöhe ist auch die Ertragssicherheit einer Sorte von wirtschaftlicher Bedeutung. [.....]“ (Roemer, 1917)Zentrales Problem: Genotyp-Umwelt-Interaktion„Von den Sorten unserer Kulturpflanzen wird heute in zunehmendem Maße gefordert, daß sie neben hohem Ertrag und einer genügend starken Ausprägung anderer erwünschter Eigenschaften die Fähigkeit besitzen, unter unterschiedlichen ökologischen Bedingungen ein gewisses Leistungsniveau zu halten. Sie sollen demnach möglichst für verschiedene Klima- und Bodenlagen geeignet sein und bei variablen Kulturbedingungen (unterschiedliche Saatzeit, Saatstärke usw.) keine allzu großen Schwankungen in den erwünschten Eigenschaften zeigen, um eine weite Verbreitung zu finden. [ ..... ]“ (Wricke, 1964)
Umwelten einer Sorte: Unterschiedliche Anbauorte, Anbaujahre, Bodenbearbeitungsvarianten, Saatzeiten, Saatstärken, Düngungs- und Bewässerungsintensitäten, Pflanzenschutzvarianten etc.
Fixierte Umweltfaktoren, die bereits vor dem Anbau feststehen (z.B. Anbauregion, Düngungsniveau oder Aussaatstärke) und zufällige Umweltfaktoren, die nicht vorhersagbar sind (z.B. die Jahreswitterung, die aber auch fixierte Faktoren beeinflussen kann, Krankheitsdruck, variierende Pflanzenschutzmaßnahmen usw.). Eine Anpassung an fixierte Umweltfaktoren ist durch den Einsatz von Spezialsorten möglich, z.B. Sorten mit besonderer Spätsaatverträglichkeit oder Winterhärte, low-input Sorten für extensive Bewirtschaftung, Glashaussorten bei Gemüse.
(a). Keine Genotyp-Umwelt-Interaktion: Umwelten wirken vollkommen gleich auf verschiedene Sorten oder Sorten reagieren auf unterschiedliche Umweltbedingungen sehr ähnlich (unwahrscheinlicher Spezialfall).
(b). Unterschiedliche Reaktionshöhe: Sorten reagieren unterschiedlich stark aber in gleiche Richtung (Zunahme oder Abnahme der Leistung) auf veränderte Umweltbedingungen. Die Rangreihung der Sorten in den verschiedenen Umwelten bleibt aber unverändert.
(c). Unterschiedliche Richtung der Reaktion: Sehr spezifische Reaktion
einzelner Sorten auf bestimmte Umwelten. Dabei reagieren einzelne Sorten
in einer Umwelt mit Leistungszunahme, während andere mit Leistungsabnahme
(in Bezug auf eine Vergleichsumwelt) reagieren. Dadurch kommt es zu einer
geänderten Rangreihung der Sorten in verschiedenen Umwelten (cross-over
interaction).
Praktischer Ansatz:
Prüfung von Zuchtstämmen/Sorten unter unterschiedlichsten Umweltbedingungen (z.B. 10 Standorte über 3 Jahre = 30 Makro-Umwelten), um Genotypen mit der größtmöglichen Ökostabilität identifizieren zu können.
Praktische Probleme bzw. Beschränkungen:
(1). Eine exakte Prüfung vieler Genotypen in vielen Umwelten ist kosten- und zeitaufwendig.
(2). Es gibt zahlreiche verschiedene Stabilitätskonzepte und damit
unterschiedliche biometrische Verfahren (Methoden) zur Erfassung der Ertragssicherheit.
Konsequenz:
Prüfung auf vielen Umwelten ist zu aufwendig und nur in späten
Generationen möglich. Für den Züchter ist daher eine “indirekte”
Selektion auf Ertragssicherheit durch Auslese auf ertragssichernde Merkmale
wie z.B. Kältetoleranz, Trockenheitstoleranz, Toleranz gegenüber
Krankheiten und Schädlinge etc. einfacher zu realisieren.
(a) Statisches Konzept:
Das Maß für die Leistungsstabilität ist die Abweichung
der Sortenleistungen vom Gesamtmittelwert der Sorte über alle Umwelten.
Eine Sorte ist stabil, wenn sie unter allen Anbaubedingungen eine möglichst gleich hohe Leistung erbringt. Die Anwendung des statischen Konzeptes zur Stabilitätsbeurteilung ist für Merkmale sinnvoll, die sich unter keinen Umständen ändern dürfen. Dies wird u. U. gefordert für Qualitätsmerkmale (max. Erucasäuregehalt, max. Glucosinolatgehalt für 00-Körnerraps, Mindest-Feuchtklebergehalt für Qualitätsweizen, Mindest-Keimfähigkeit von Braugerste ...), Resistenzen gegen Krankheiten oder Streßmerkmale (Winterhärte, Trockenheitstoleranz etc.).(b) Dynamisches Konzept:
Nachteil des statischen Konzeptes: Die Tatsache, daß es Standorte mit grundlegend unterschiedlicher Produktivität gibt, wird nicht berücksichtigt (z.B. Trockengebiet - Feuchtgebiet in Österreich).
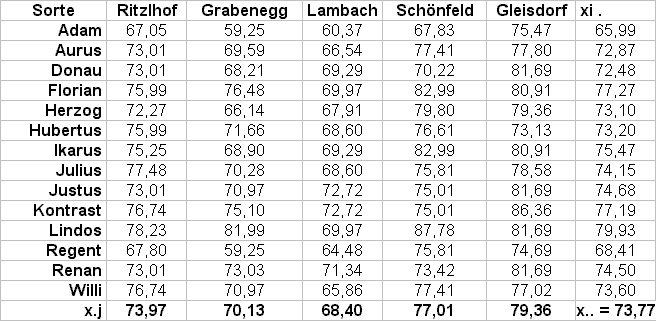
Tab. 1: Modellbeispiel mit Ertragsdaten (dt/ha, BA Pflanzenbau 1995)

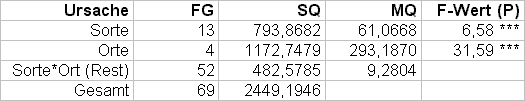
Tab. 2: Varianzanalyse zu obigem Beispiel
(a) Umweltvarianz und Variationskoeffizient (Roemer, 1917)
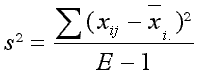
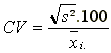
(b) Ökovalenz (Wricke, 1962; 1964) und Stabilitätsvarianz
(Shukla, 1972)
Beruht auf der Aufteilung der GEI auf die einzelnen Sorten. Die Sorte, die den kleinsten Wert zur gesamten GEI beiträgt, ist die stabilste.
Praktisch: Für jede Sorte i wird die Summe der Abweichungsquadrate der Sorte über die verschiedenen Umwelten gebildet. Ökovalenz der Sorte i = Wi. Anschließend werden die Sorten nach ihren Wi-Werten gereiht. Die Summe der Wi-Werte entspricht der Abweichungsquadratsumme (SQ) der GEI.
![]()
Shukla’s ‘stability variance’ si² ist eine lineare Kombination der Ökovalenz und zeigt somit zu dieser einen Rangkorrelationskoeffizienten von 1; si² kann, da sie eine Differenz zwischen zwei Abweichungsquadratsummen ist, auch Werte von kleiner als Null annehmen, in diesem Falle wird si² gleich Null gesetzt.
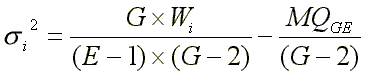
(c) Regressionsmethode (Eberhart & Russell, 1966)
Die Beurteilung der Stabilität einer Sorte erfolgt anhand der Regression der Sortenwerte auf die Umweltmittelwerte (‘environmental indices’).
Dadurch ergeben sich praktisch zwei Parameter (Abb. 1 und 2):
bi : Regressionskoeffizient der Sorte i (Anstieg der sortenspezifischen Regressionsgerade)
s2di : Abweichungsquadratsumme für
die Sorte i (ist ein Maß für die Streuung um die Regressionsgerade)
Interpretationsmöglichkeiten:
Der Regressionskoeffizient für eine bestimmte Sorte kann je nach Steigung der Regressionsgerade kleiner, gleich oder größer 1 sein.
Wenn bi > 1: "Intensivsorte", die in produktiveren Umwelten einen überdurchschnittlichen Leistungsanstieg erbringt.
Wenn bi < 1: "Extensivsorte", reagiert nicht auf produktivere Umweltbedingungen, kann aber u.U. auf Extremstandorten eine bessere Leistung als eine "Intensivsorte" bringen.
Die Abweichungsquadratsumme gibt Auskunft über die Streuung der
Sorte um die Regressionsgerade, diese ist das eigentliche Stabilitätsmaß,
das die "Ertragstreue" der Sorte charakterisiert.
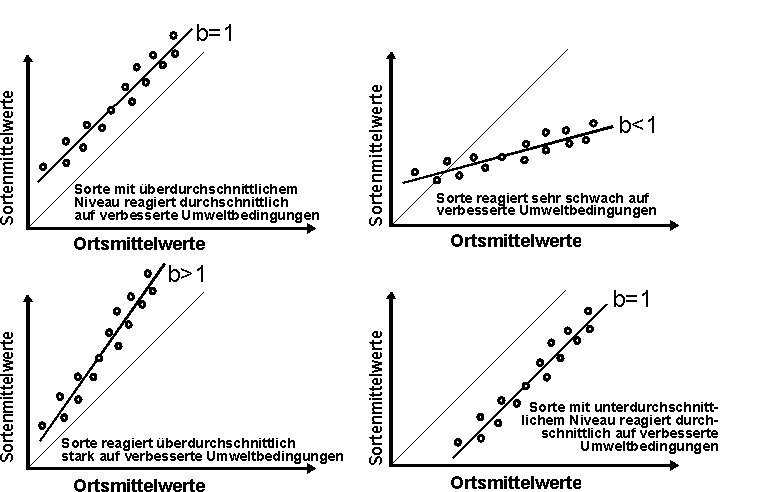
Abb. 1: "Reaktionsparameter" bi unterschiedlicher
Sorten und dessen Interpretationsmöglichkeiten
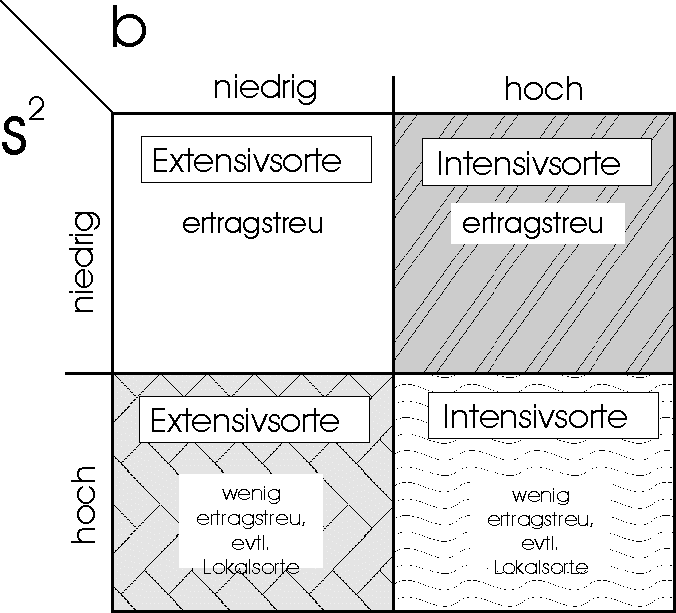
Abb. 2: Beurteilung der Sortenleistung nach dem Regressionsmodell
unter Verwendung von bi als "Reaktionsparameter" und
s²di
als "Stabilitätsparameter" (nach Haufe und Geidel 1978)
(d) Nichtparametrische Methoden (Huehn, 1990)
Nichtparametrische Stabilitätsparameter wie die mittlere Rangdifferenz Si(1) und die Varianz der Ränge Si(2) basieren auf Ranginformationen. Da die phänotypische Stabilität unabhängig von Genotypeffekten bestimmt werden soll, werden die Beobachtungswerte xij vor der Rangreihung korrigiert. Die korrigierten Beobachtungswerte xij* hangen nur mehr von der GEI und einem Fehler ab.
![]()
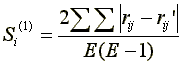
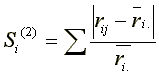
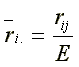
Ein „Hybrid“ zwischen univariaten und multivariaten Methoden ist die
AMMI (additive main effects and multiplicative interaction) Prozedur.
Dabei wird zuerst eine Varianzanalyse mit den Hauptfaktoren Genotyp und
Umwelt berechnet. Anschließend wird der GEI-Term der ANOVA einer
Hauptkomponentenanalyse (principal component analysis) unterzogen.
Die Darstellung des Ergebnisses erfolgt i.d.R. graphisch durch den sogenannten
bi-plot
(Abb.3).
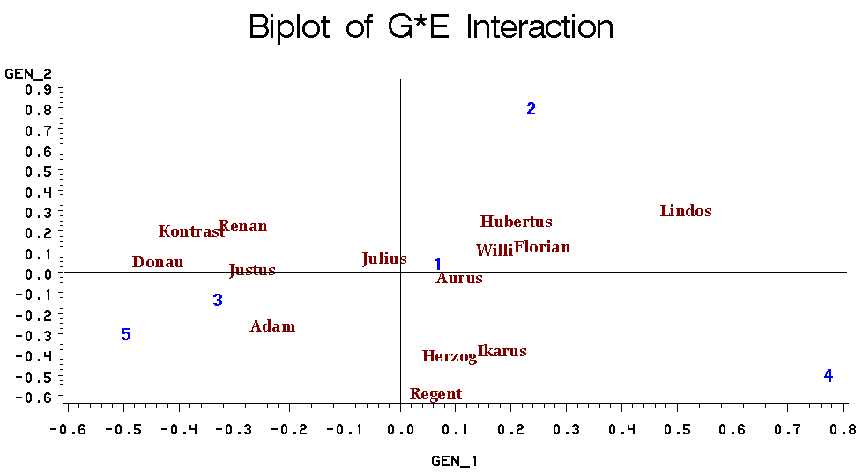
Abb. 3: Bi-plot der GEI des Modellbeispiels. Die beiden ersten
Hauptkomponenten sind für 82,78 % der Gesamt-GEI verantwortlich. Eine
Sorte nahe dem Schnittpunkt (z.B. Julius, Aurus) zeichnet sich durch
generelle Adaptation aus. Sorten mit einer hohen ersten Hauptkomponente
(GEN_1) (z.B. Lindos) kennzeichnen sich durch eine spezifische Adaptation
aus.
Durch Clusteranalysen kommt es nicht im eigentlichen Sinne zu einer
Beschreibung der Stabilität, sondern zur Gruppierung der Prüfglieder
in einzelne Gruppen (cluster). Anhand einer mitgeführten, stabilen
Standardsorte (z.B. Julius) können die einzelnen Gruppen auch
entsprechend ihrer Stabilität beurteilt werden (Abb. 4).
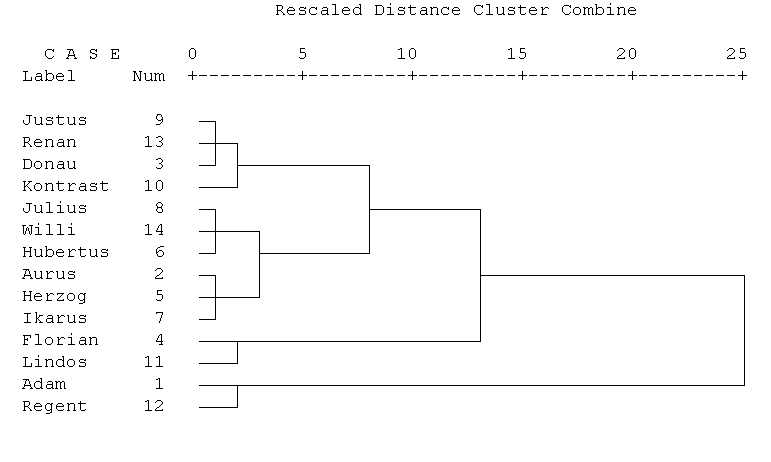
Abb. 4: Clusteranalyse des Modellbeispiels. In der Mitte befindet
sich der Cluster mit den stabilen Sorten (Julius, Willi, Hubertus, Aurus,
Herzog, Ikarus). Etwas geringere Stabilität zeigt der Cluster
mit den Sorten Justus, Renan, Donau und Kontrast. Die
instabilen Sorten Florian, Lindos, Adam und Regent bilden
zwei Cluster, die von den beiden vorher erwähnten weiter entfernt
sind.
(f) Methoden unter Berücksichtigung des Leistungsniveaus
Während bei den „klassischen“ Stabilitätsparametern das absolute Leistungsniveau unberücksichtigt bleibt, wurden von praxisorientierter Seite auch einige Parameter entwickelt, in denen versucht wurde die Leistung und Stabilität zu kombinieren. Beispiele dafür sind die rank sum method von Kang (1988), die später modifiziert wurde, die Methode eines safety first index von Eskridge (1990), oder die floating checks von Jensen (1976). Auch Huehn (1990) entwickelte einen nichtparametrischen Parameter Si(3), der das Leistungsniveau einfliessen läßt.
Rank sum method: Die Genotypen werden entsprechend ihrer Leistung mit Rängen versehen, wobei der Genotyp mit der höchsten Leistung den Wert 1 erhält usw. Anschließend erfolgt eine Rangreihung entsprechend ihrer Stabilität (z.B. Ökovalenz), wobei jener Genotyp den ersten Rang erhält der die höchste Stabilität zeigt, also den geringsten Wi-Wert besitzt. Es wird die Summe der beiden Ränge gebildet. Ein stabiler und leistungsfähiger Genotyp sollte einen entsprechend niedrigen Wert haben.
Safety first index: Es wird eine untere Konfidenzgrenze für die Leistung eines Genotyps berechnet, die nur bei einer festgelegten Risikowahrscheinlichkeit unterschritten wird. Dazu wird vom Sortenmittelwert ein Term abgezogen in dem der Perzentilwert der Risikowahrscheinlichkeit, die Stabilität sowie die Varianzkomponente des Umwelthaupteffektes einfliessen. Je höher der safety first index umso höher die „sichere“ Leistung eines Genotyps.
Floating checks: Es werden auf allen Umwelten die Genotypen
mit der höchsten Leistung (site highest yield) bestimmt und
anschließend ein Mittelwert der Höchsterträge berechnet.
Dieser Mittelwert wird 100 gesetzt. Die Genotypmittelwerte über alle
Umwelten werden in Verhältnis zum durchschnittlichen Höchstertrag
gesetzt und prozentuell ausgedrückt. Je näher ein Genotyp bei
100 ist, umso höher ist seine Leistung über alle Umwelten.
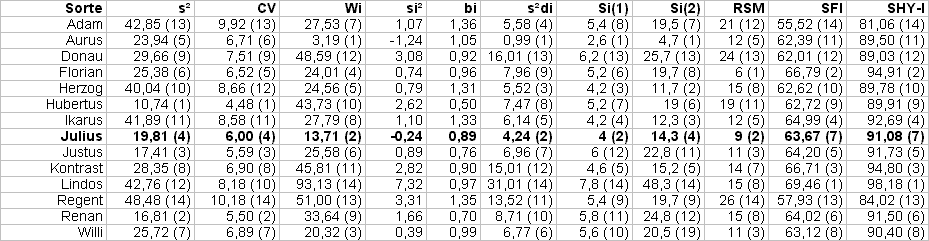
Tab. 3: Verschiedene Stabilitätsparameter für das in Tab. 1. angeführte Modellbeispiel: s² ... Umweltvarianz, CV ... Variationskoeffizient, Wi ... Ökovalenz, si² ... Stabilitätsvarianz, bi ... Regressionskoeffizient, s²di ... Abweichungsquadrate von der Regressionsgeraden, Si(1) ... mittlere Rangdifferenz, Si(2) ... Varianz der Ränge, RSM ... Rangsummenmethode, SFI ... untere Konfidenzgrenze bei a=0.05, SHY-I ... Durchschnittsertrag in Prozent des mittleren Höchstertrages. In Klammer stehen die entsprechend des Stabilitätsparameters verteilten Ränge.
Literatur
Becker HC, Léon J, 1988: Stability analysis
in plant breeding. Plant Breeding 101: 1-23.
Dorst JC, 1957: Adaptation. Euphytica 6: 247-254.
Eberhart SA , Russel WA, 1966: Stability parameters
for comparing varieties. Crop Science 6: 36-40.
Eskridge KM, 1990: Selection of stable cultivars
using a safety-first rule. Crop Science 30: 369-374.
Flores F, Moreno MT, Cubero JI, 1998: A comparison
of univariate and multivariate methods to analyze G x E interaction. Field
Crops Research 56: 271-286.
Haufe W, Geidel H, 1978: Zur Beurteilung der Ertragssicherheit
von Sorten und Zuchtstämmen. I. Definitionen, Stabilitätsparameter
und deren Interpretationsmöglichkeiten. Zeitschrift für Pflanzenzüchtung
80:24-37.
Huehn M, 1990: Nonparametric measures of phenotypic
stability. Part 1: Theory. Euphytica 47: 189-194.
Jensen NF, 1976: Floating checks for plant breeding
nurseries. Cereal Research Communications 4: 285-295.
Kang MS, 1988: A rank-sum method for selecting
high-yielding, stable corn genotypes. Cereal Research Communications 16:
113-115.
Lin CS, Binns MR, Lefkovitch LP, 1986: Stability
analysis: where do we stand? Crop Science 26: 894-900.
Roemer T, 1917: Sind die ertragreichen Sorten
ertragssicherer? Mitteilungen der Deutschen Landwirtschaftlichen Gesellschaft
32: 87-89.
Shukla GK, 1972: Some statistical aspects of partitioning
genotype-environmental components of variability. Heredity 29: 237-245.
Wricke G, 1962: Über eine Methode zur Erfassung
der ökologischen Streubreite in Feldversuchen. Zeitschrift für
Pflanzenzüchtung 47: 92-96.
Wricke G, 1964: Zur Berechnung der Ökovalenz
bei Sommerweizen und Hafer. Zeitschrift für Pflanzenzüchtung
52: 127-138.
Siehe auch: Selektion